アメリカのストーワーズ医学研究所(SIMR)で行われた研究により、驚異的な再生力で知られるプラナリアは、腸が離れた場所から幹細胞の位置や働きをコントロールすることで再生を行っている可能性が示されました。
これまで、幹細胞は周囲の細胞が直接接触して管理する仕組みによって制御されていると考えられてきましたが、今回の研究は、腸による幹細胞の遠隔操作が再生を促すという常識を覆す結果となっています。
一体どのような仕組みが、この「接触ゼロ設計」を可能にしているのでしょうか?
研究内容の詳細は2025年10月15日に『Cell Reports』にて発表されました。
目次
- なぜプラナリアは自由自在に再生できるのか?
- プラナリアの再生は腸からの遠隔指示で幹細胞が操られている
- 再生力を操る腸—その可能性と課題
なぜプラナリアは自由自在に再生できるのか?
世の中には、身体の一部を失っても、また完全に再生してしまう生き物が存在します。
代表的なのは、淡水に生息する小さな扁形動物「プラナリア」です。
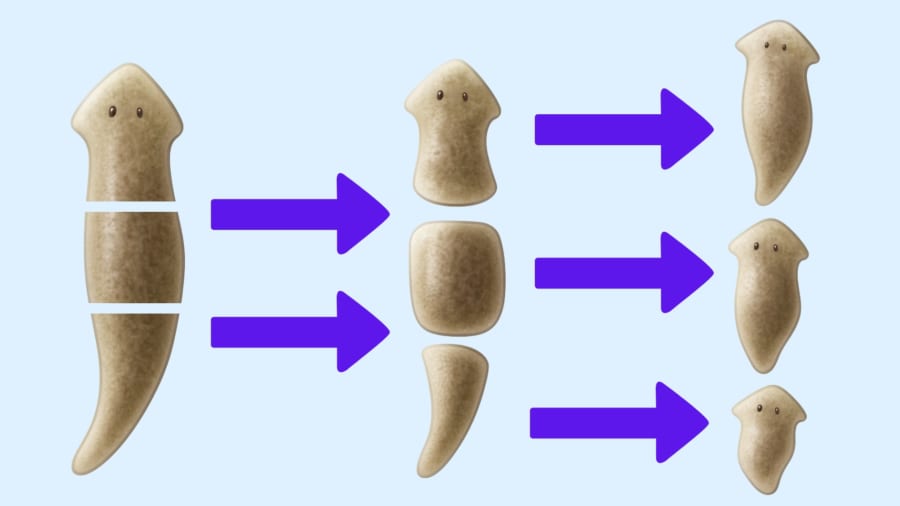
この生き物の再生能力は桁外れで、なんと体のどこを切り落としても、失った部分を丸ごと再び作り出せてしまいます。
それどころか、体が粉々に近い小さな断片になったとしても、そこから完全な個体を再生することすら可能なのです。
19世紀の報告では、プラナリアを体のごく小さな断片(最小でおよそ全身の1/279)に分けても、それぞれが新しい個体として再生したとされています。
まさに信じられない話ですが、これは古くから知られる科学的事実でもあります。
もし人間も同じような力を持っていたら――そんな想像をすると、驚きを通り越してちょっと怖いほどですね。
しかし、なぜプラナリアだけがこれほど自在に再生できるのでしょうか?
その謎を解くカギとなるのが「幹細胞」です。
幹細胞とは、体を構成するあらゆる種類の細胞に変身(分化)できる特殊な細胞のこと。
一般に、動物の幹細胞は体内の決まった場所に集まり、その場所にいる細胞から常に指示を受けて働いています。
この「幹細胞が周囲の細胞から指示を受ける仕組み」を専門用語では「幹細胞ニッチ(幹細胞の巣という意味)」と呼びます。
例えば、人間の血液は赤血球や白血球など、いくつもの種類の細胞からできていますが、これらをつくり出す「造血幹細胞」という特別な細胞があります。
この造血幹細胞は体のどこにでもいるわけではなく、「骨髄」という骨の内部にある特別な場所に集まっています。
なぜそんな場所にいるかというと、造血幹細胞は周囲の細胞たちから常に「もっと増えてください」とか「そろそろ赤血球や白血球に変化してください」というような具体的な指示を受けているからです。
つまり、造血幹細胞の周囲には幹細胞を管理している細胞がいて、自由に勝手な行動ができないよう、常に細かな指示を出しているのです。
このように幹細胞を取り巻いて厳しく管理している環境のことを、専門用語では「ニッチ(巣という意味)」と呼びます。
研究者の中には、このニッチのことを細かく部下の行動をチェックする「マイクロマネージャー(鬼上司)」にたとえて、幹細胞を過保護に管理していると表現する人もいます。
ところが、プラナリアの場合はそうした分かりやすい「ニッチ=鬼上司」という仕組みがうまく当てはまりません。
なぜなら、プラナリアの幹細胞は人間と違い、体の特定の場所にまとまっているわけではなく、まるで種をまいたように体の中の至るところに広く散らばっているからです。
散らばった幹細胞の周りにはいろいろな種類の細胞がいて、それぞれが幹細胞に影響を与える可能性があります。
そうなると、誰が本当の上司で、どの細胞が指示を出しているのかをはっきり特定することが非常に難しくなってしまいます。
にもかかわらず、プラナリアは体がいくら切断されても、いつも迷うことなくきれいに再生を成功させています。
一体どのようにして、プラナリアの幹細胞は迷わず的確に再生を行っているのでしょうか?
幹細胞は、上司役であるニッチがいなくても、自由に動き回って体を再生するということなのでしょうか?
それならば、プラナリアの幹細胞はどうやって無秩序に増殖することなく、きちんと再生を行えるのでしょうか?
こうした矛盾は、長い間、科学者を悩ませてきました。
そこで今回、研究チームはこの謎に正面から挑むことを決意したのです。
研究チームは、最新の解析技術を駆使してプラナリアの体内を徹底的に調べ上げ、幹細胞が働く舞台裏に何があるのかを明らかにしようと試みました。
果たしてプラナリアの驚異的な再生の秘密は、明らかになったのでしょうか?
プラナリアの再生は腸からの遠隔指示で幹細胞が操られている

再生の達人・プラナリアの体内では、一体どんな仕組みが働いているのでしょうか?
研究チームはその謎を解明するために、最新技術を駆使してプラナリアの体内に迫りました。
「空間遺伝子解析技術」(spatial transcriptomics)という最先端の手法を使い、再生中のプラナリア体内で、どの細胞が幹細胞の近くにいて、どのような遺伝子が働いているのかを細かくマッピングしたのです。
その結果、まず研究者の目に留まったのが、幹細胞の周りを取り巻く特別な細胞たちでした。
その一つはこれまで知られていなかった、少し風変わりな分泌細胞です。
この細胞は、細胞膜から多数の細い突起を無数に伸ばしていて、まるで手を何本も持つような奇妙な形をしていました。
研究者たちは、この巨大な細胞にギリシャ神話の「百本腕の巨人・ヘカトンケイル」をなぞらえ、「ヘカトンブラスト」というユニークな名前を付けました。
もう一つ、注目を集めたのが「腸」の細胞でした。
腸といえば消化器官であり、幹細胞の再生機能とは直接関係なさそうです。
ところが解析してみると、幹細胞の周囲には分泌細胞であるヘカトンブラストがもっとも多く、次に多かったのがなんと「腸の細胞」だったのです。
つまり、幹細胞が再生の指示を受けるかもしれない細胞として、この二種類が特定されたというわけです。
この二種類の細胞は、幹細胞に対して一体どんな役割を担っているのでしょうか?
研究者たちはまず、幹細胞に最も近く、非常に目立つ存在であるヘカトンブラストの役割を確かめることにしました。
この細胞は位置関係だけを見ると、幹細胞を守るボディーガードか付き人のようにも思えます。
もしこの細胞が幹細胞の再生能力を支えているなら、ヘカトンブラストを取り除いたときに再生能力が落ちるはずです。
そこで研究チームはRNA干渉法(RNAi)という技術で、ヘカトンブラストを選択的に減少させる実験を行いました。
ところが結果は予想外のものでした。
ヘカトンブラストを減らしても、幹細胞の活動はほとんど変化せず、プラナリアは通常通り再生を続けたのです。
再生速度にわずかな変化はありましたが、再生そのものが止まることはありませんでした。
つまり、大きくて目立つこの細胞は、「再生の黒幕」どころか、「いてもいなくてもそれほど影響しない」存在だったというわけです。
それでは、もう一つの候補である腸の細胞はどうでしょうか?
腸の細胞が幹細胞を動かす役割を担っているとは、なかなか信じがたいところです。
腸というのは栄養を消化する器官であり、幹細胞の働きに口を出す理由はないように思えるからです。
研究チームはその意外な可能性を検証するため、幹細胞の近くに存在した腸の細胞で働いている遺伝子をRNA干渉法で抑制し、その後の再生を観察しました。
その結果は驚きでした。
腸の細胞で働く特定の遺伝子を止めると、幹細胞が傷口付近に正しく集まらなくなり、再生のために必要な幹細胞の増殖スピードも明らかに遅くなってしまったのです。
腸が、幹細胞に「集まれ」「再生せよ」という号令を掛けていた可能性が示されたわけです。
では、腸がないプラナリアの欠片は再生しないのでしょうか?
プラナリアの腸管は、体の中心部を通って枝分かれしながら全身に広がっており、消化した栄養を各部位に運ぶという役割もしています。
今回の研究で明らかになったのは、腸の細胞で働く特定の遺伝子(tub-αなど)の機能を抑えると、幹細胞が上手く増殖したり適切な場所に集まることが難しくなり、再生が正常に進まなくなる、ということです。
言い換えれば、「腸が全く存在しない」場合だけでなく、「腸が存在していても腸から幹細胞へのシグナルが正常に働かない」場合にも、プラナリアの再生が上手く進まない可能性が高いと考えられます。
つまり、腸管の存在自体ももちろん大切ですが、それ以上に腸管から送られるシグナルが非常に重要だということです。
研究自体は腸を物理的に完全除去した切片は試していませんが、腸を機能的に止めるだけで再生が大きく崩れることから、腸をまったく含まない切片では再生が強く阻害される可能性が高いと考えられます。
実際、論文では幹細胞が「腸の枝」に挟まれるように分布していると表現されています。
既存の研究でも、腸の分岐形成や腸から出る物質が幹細胞の増殖・分化・再生に関わることが報告されています。
つまり腸は再生を支える「司令塔」のひとつであり、完全にない場合は再生が大きく不利になると考えられます。
少しSFっぽく言えば、腸は「再生核」とも言えるでしょう。
コラム:なぜ腸が司令塔なのでしょうか?
まず一つ目は、腸が全身に栄養を運ぶ役割を担っているからという考え方です。腸はプラナリアの体の中心に広がる分岐した管のネットワークで、全身に栄養を届けています。そのため、腸は体の各部分がどれだけ栄養を必要としているか、あるいは損傷しているかを感知しやすい位置にあると考えられています。つまり、腸から送り出される分子シグナルが幹細胞の活動を同調させる可能性があり、それをもとに幹細胞へ指令を出していると考えられます。実際、今回の研究でも、腸の細胞で働く遺伝子が幹細胞の動きを調整することが示されており、腸が遠隔で制御しているという考え方を支持する結果となっています。
二つ目は、腸が古い進化の歴史を持つ臓器であるためだ、という仮説です。動物の進化において、消化管は非常に早い段階で登場した器官の一つとされています。そのため、腸が進化の過程で全身の再生や成長を調整する役割を担い、その機能が今のプラナリアにも受け継がれている可能性があるのです。(※最近の研究では腸の他にも体壁筋なども再生する体の座標づけに関与すること報告されています)
要するに、「腸は体内の栄養や損傷の状態を把握しやすく、進化的にも古くからある重要な器官だからこそ、再生を調整する司令塔としてふさわしい位置にある」と考えられています。
研究チームはさらに、電子顕微鏡を使って細胞間の距離を正確に調べました。
すると驚くことに、幹細胞は腸の細胞と直接触れていませんでした。
両者の間には少なくとも約1200ナノメートル(およそ細胞1個分の距離)があり、接触は見られなかったのです。
また、幹細胞は近くのヘカトンブラストなどの細胞とも、細胞同士をしっかり繋ぐ「細胞間接着」をほとんど形成していませんでした。
言い換えれば、プラナリアの幹細胞は、まるでワイヤレス通信で指令を受けているように、離れた場所からのシグナルだけで動いている可能性が高いのです。
研究者らはこうまとめています。
「ヘカトンブラストのようなすぐそばにいる細胞は再生にとって必須ではなく、むしろ腸のように少し離れた場所の細胞が幹細胞の働きを制御しているのだろう」。
直接触れず、遠隔で幹細胞をコントロールするという驚くべき仕組みが、プラナリアの再生を支えているのかもしれません。
再生力を操る腸—その可能性と課題
今回の研究が教えてくれた最も大切なポイントは、プラナリアの再生を指揮している「司令塔」が、意外にも「腸」だったということです。
これまで多くの生き物では、幹細胞という特別な細胞は、近くの細胞が直接触れて細かな指示を与えることで管理されると考えられてきました。
幹細胞はそこで周囲の細胞から、「今は増えて」「次は別の細胞になって」といった明確な指示を受け取っています。
しかしプラナリアでは、こうした近くの細胞から直接指示を受けるという仕組みがあまり重要ではないようなのです。
腸は通常、消化を担当する器官であり、再生とは無関係に思えるかもしれません。
ところがプラナリアの腸は、体の中心から枝分かれし、全身にネットワークのように広がっており、まるで幹細胞の位置や増殖を遠隔操作する司令塔のように働いていました。
つまりプラナリアの再生が成功するカギは、直接触れる細胞の管理だけではなく、腸から送られる「遠隔のシグナル」にあったのです。
幹細胞は腸からの「集まって」「再生を開始しなさい」という離れた場所からの合図を受けて、初めて的確に行動できるのだと考えられます。
この発見が私たちにとって意味するのは、「幹細胞ニッチ」という考え方を、より柔軟に考える必要があるということです。
幹細胞は、必ずしも近くの細胞に囲まれた固定的な環境だけではなく、離れた臓器や組織からのシグナルでも動くことができるという、新しい視点を示しているのです。
今回プラナリアで確認された「遠隔の細胞同士が指示を送り合う仕組み」は、将来的に再生医学の研究に新たなヒントを与える可能性があります。
もし人間の幹細胞にも、プラナリアのような「離れた場所からの指令」が一部でも存在するなら、損傷した組織を修復する仕組みの理解が進むかもしれません。
ただ今回の結果をすぐに人間の医療に応用できるかと言えば、そう簡単な話ではありません。
なぜなら、人間の体とプラナリアの体では、その構造も管理の仕組みもまったく異なっているからです。
特に人間の幹細胞は、「ニッチ」という仕組みによって厳しく管理されており、その管理を緩めてしまうと、がん細胞のように制御不能に増殖する恐れがあります。
言い換えれば、プラナリアのような自由度が高すぎる幹細胞の仕組みをそのまま人間に取り入れることは、リスクを伴う可能性があります。
ですから、この新しい再生メカニズムを人間の医療に安全に活かすためには、まだ多くの課題が残されているのです。
それでも、今回の発見が非常に重要であることに変わりはありません。
幹細胞が周囲の細胞とどのようにコミュニケーションを取り、身体の再生という高度な作業をやり遂げているのか――その根本的な仕組みに新たな光が当てられたのです。
特に今回明らかになった「腸が離れた場所から幹細胞を制御する仕組み」は、再生生物学全体に新しい視点をもたらしました。
これまで見逃されていた「距離を超えた細胞同士のやりとり」という可能性は、今後さらに詳しく調べるべきテーマとなるでしょう。
研究者たちが次に挑むべきは、腸の細胞が実際にどのような分子を使って幹細胞の動きを指示しているのかを明らかにすることです。
腸で働く遺伝子tub-αなどが有力な候補とされていますが、その働きの仕組みはまだ分かっていません。
もしかすると、人類が自分の再生能力をより深く理解し、高めていくカギは、この小さな再生の名人・プラナリアから学ぶことで見つかるのかもしれません。
今回の研究が明らかにしたプラナリア流の新しい幹細胞管理の方法は、将来の再生医療に新たな可能性をもたらす一歩となるでしょう。
元論文
Molecular and cellular characterization of planarian stem cell microenvironments
https://doi.org/10.1016/j.celrep.2025.116401
ライター
川勝康弘: ナゾロジー副編集長。 大学で研究生活を送ること10年と少し。 小説家としての活動履歴あり。 専門は生物学ですが、量子力学・社会学・医学・薬学なども担当します。 日々の記事作成は可能な限り、一次資料たる論文を元にするよう心がけています。 夢は最新科学をまとめて小学生用に本にすること。
編集者
ナゾロジー 編集部