生き物の体には「体内時計」とも呼ばれる24時間周期のリズム(概日リズム)が備わっており、睡眠や代謝などの重要な働きを規則正しく管理しています。
その仕組みは数フェトムリットルしか体積がないシアノバクテリアにも備わっており、極小の細胞内に極めて正確な時計が存在しています。
アメリカのカリフォルニア大学で行われた研究によって、この極小の体内時計の仕組みを人工の細胞で再現することに成功し、小さな人工細胞が規則正しく時間を刻むことを示しました。
この発見により、細胞内部に避けられず存在する分子のゆらぎ(ノイズ)があっても体内時計が正確に動き続ける仕組みに光が当てられました。
なぜ極小の細胞は正確な時を刻むことができたのでしょうか?
研究内容の詳細は2025年7月21日に『Nature Communications』にて発表されました。
目次
- 微生物が見せる驚異の精度、その謎に迫る
- 生命の時計、人工細胞で再現成功
- 【まとめ】生物の体内時計、その正確さを保つ2つの鍵
微生物が見せる驚異の精度、その謎に迫る
私たち人間をはじめ、多くの生き物の体には、約24時間のリズムを生み出す「体内時計(概日リズム)」と呼ばれる仕組みがあります。
これは、朝になれば自然に目が覚め、夜には自然と眠くなるといった日常の生活リズムを整えているだけでなく、体温の変化やホルモンの分泌、さらには代謝活動など、体のさまざまな機能を正確に調整する重要な働きを担っています。
動物だけでなく、植物が花を咲かせるタイミングや、微生物が活動を始める時間帯まで、生物界には「時計」があらゆるところに存在しているのです。
このように生命にとって非常に重要な仕組みである体内時計ですが、その中でも特に驚くほど正確な時計を持つ生物として、シアノバクテリア(ラン藻)と呼ばれる非常に小さな微生物が知られています。
シアノバクテリアは地球上に広く存在する光合成を行う細菌で、その一種である「Synechococcus elongatus(シネココッカス・エロンガトゥス)」は、わずか数フェムトリットル(1フェムトリットルは10⁻¹⁵リットル、つまり1000兆分の1リットルという非常に微小な体積)の小さな細胞しか持ちません。
この極めて小さな細胞の中に、高精度の24時間時計が備わっているというのは驚異的です。
しかもこの細胞たちは、それぞれが独立しているにもかかわらず、ほぼズレなく完璧な24時間周期を維持しており、互いに時計を合わせるための情報交換をしているわけでもありません。
動物なら神経やホルモンを介して時間を合わせることができますが、シアノバクテリアはそれなしで完全に同期した時間を刻み続けるのです。
では、一体どのような仕組みで、こんなに小さな細胞がこれほどまでに正確な時計を持つことが可能なのでしょうか。
その謎は長い間研究者の間でも明らかになっていませんでしたが、近年の研究によって、この謎を解くための重要な手がかりが見えてきました。
シアノバクテリアの体内時計の仕組みは、大きく2つの要素から成り立っていることがわかっています。
一つ目は、「転写・翻訳フィードバックループ(TTFL)」と呼ばれる、遺伝子がタンパク質を作り出す働きを介した時計の仕組みです。
これは遺伝子のオンオフを繰り返すことで、リズムを調整しています。
もう一つは「ポスト翻訳型振動子(PTO)」と呼ばれるもので、これは遺伝子ではなく、タンパク質そのものが直接相互作用しあうことで時間を刻む仕組みです。
シアノバクテリアの場合、このPTOという仕組みが時計の中核を担っており、特に重要な役割を果たしています。
このPTOを構成しているのが、KaiA、KaiB、KaiCというたった3種類のタンパク質です。
シアノバクテリアの細胞内では、KaiCが「リン酸」という化学タグを付けたり外したりすることでリズムを作り出します。
KaiAはこのリン酸を付ける反応を促進し、KaiBは逆にリン酸を外す反応を助ける役割を持っていて、これらの相互作用のバランスによって、約24時間周期の振動が作られるのです。
実際、この3種類のタンパク質とATPというエネルギー物質を試験管の中で混ぜるだけで、自然に24時間の周期を持った振動(リン酸が付いたり外れたりするサイクル)が何日間も続くことが、2005年ごろに初めて発見されました。
これは生物時計の研究において画期的な成果であり、「生物の時計は非常に単純な仕組みで動くのだ」という驚きを科学者たちに与えました。
しかし、こうした試験管での実験には重要な限界がありました。
試験管内の反応は通常100マイクロリットル(10万分の1リットル)ほどの比較的大きな溶液で行われますが、これは実際のシアノバクテリアの細胞の体積(数フェムトリットル)に比べると途方もない差があります。
このようなサイズの違いによって、試験管内で観察される時計の振る舞いが、実際の生きた細胞でどのように正確に再現されているのかを直接的に確かめることはできませんでした。
さらに、本物の細胞内では、先ほど述べたTTFL(遺伝子による仕組み)とPTO(タンパク質による仕組み)が複雑に絡み合い、互いに影響を与え合っています。
そのため、それぞれの仕組みが時計の正確さにどのように貢献しているのかを正確に調べることも非常に難しかったのです。
そこで今回の研究チームは、この試験管実験の限界を乗り越えて、実際の細胞の環境に近い非常に小さな空間で、シアノバクテリアの時計タンパク質が本当に正確なリズムを刻むことができるのかを調べることに挑戦しました。
試験管ではなく、より小さく細胞に近い人工的な細胞を作り、その中で時計がどのように動くかを実際に観察することで、「生きた細胞の中の体内時計の謎」を解き明かそうと考えたのです。
このような実験を通じて、研究チームが解き明かしたかったのは主に以下の2つの疑問でした。
(1)極めて小さな細胞内の環境で、24時間周期のリズムを正確に維持するためには何が必要なのか?
(2)シアノバクテリアの時計を構成する「遺伝子が関わる仕組み(TTFL)」と「タンパク質だけの仕組み(PTO)」のうち、それぞれが時計の精度や安定性にどれくらい重要な役割を果たしているのか?
これらの疑問を明らかにすることで、生物が体内時計をいかに精巧に作り上げてきたかという生命の基本的な謎を解明できるかもしれないと期待されたのです。
研究チームはこうして、これまでの試験管の限界を超え、よりリアルな細胞モデルを作って体内時計の仕組みを調べることに踏み切ったのです。
生命の時計、人工細胞で再現成功
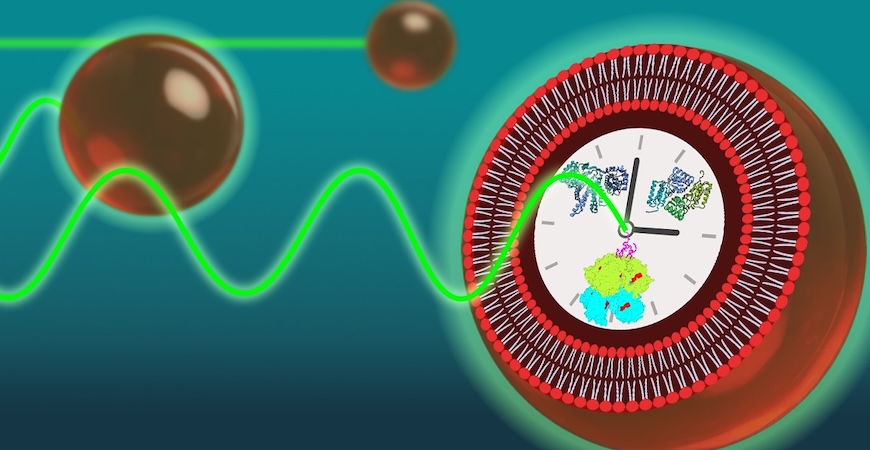
シアノバクテリアが小さな細胞の中で、なぜ正確に24時間という周期を保てるのかを明らかにするために、研究チームは「人工細胞」を使った新たな実験に挑戦しました。
ここで言う人工細胞とは、本物の生きた細胞ではなく、人工的に作った細胞そっくりの構造体のことです。
これは脂質でできた小さな膜の袋のようなもので、「巨大一重膜小胞(GUV)」と呼ばれています。
大きさはおよそ2〜10マイクロメートル(1マイクロメートルは1000分の1ミリ)で、ちょうど本物の細胞と同じぐらいのサイズです。
次に研究チームは、試験管よりずっと細胞に近い小さな空間を持つ人工細胞(GUV)を作り、その中にKaiタンパク質を閉じ込めることで、実際の細胞の状況に近い条件で時計が動くかを調べることにしました。
具体的には、KaiA、KaiB、KaiCの3種類のタンパク質を混ぜた溶液を人工細胞(GUV)の内部に入れました。
KaiBには特殊な蛍光タグを付けておき、タンパク質の動きを顕微鏡で直接観察できるように工夫しました。
このタグがついたKaiBは、KaiCと結合すると光り方が変化するため、光の強さを測定することで、時計のリズムが正しく刻まれているかを視覚的に確認できるのです。
作られた人工細胞(PTO-GUVと呼ばれます)は小さなガラス板の上に固定され、数日間にわたって顕微鏡を使って観察されました。
その結果、多くの人工細胞でKaiBの蛍光の強さが約24時間周期で規則正しく変動し、確かに時計が正しく機能していることが確認されました。
言い換えれば、小さな袋の中に閉じ込められたタンパク質が、自分自身で周期的なリズムを作り出しているのです。
しかし、興味深いことに、すべての人工細胞がこのようにうまく時計として機能したわけではありませんでした。
Kaiタンパク質の量が少ない場合や、人工細胞のサイズが特に小さい場合には、途中でリズムが消えてしまったり、最初から振動が見られないケースも多く観察されました。
このことから、時計としての機能を維持するには、ある一定以上のタンパク質量と細胞サイズが必要だとわかったのです。
実際に観察された人工細胞は、大きく分けて2種類に分類できました。
一方はきちんとリズムを刻み続ける「時計として動く人工細胞」、もう一方は「最初から全く動かない、または途中で止まってしまう人工細胞」です。
研究チームはこの現象を詳しく調べるため、「時計の忠実度(fidelity)」という指標を使いました。
忠実度は、人工細胞全体のうち、正しくリズムを刻めている細胞がどのくらいの割合いるかを表します。
例えば、忠実度が1なら全ての人工細胞が振動していることを示し、忠実度が0ならばどの細胞も振動していないことを意味します。
忠実度を計算した結果、人工細胞が小さくなったり、中のタンパク質の量が少なくなったりするほど、忠実度が明確に低下することがわかりました。
反対に、タンパク質の量が多くなればなるほど、時計として安定して機能する人工細胞の割合が高くなりました。
さらに振動が持続した細胞に関しては、その周期(約24時間)は細胞のサイズやタンパク質量にほぼ左右されないことも明らかになりました。
つまり、時計が動き出せば必ず約24時間周期を刻みますが、条件が悪いと最初から動き出すことすらできないということです。
研究チームはさらに、この実験結果を説明するために、コンピューターで数理モデル(数学的に再現したシミュレーション)を作りました。
このモデルを使った解析によって、なぜタンパク質の量が多いほど時計が安定するのか、という疑問にも答えることができました。
モデルによる解析の結果、タンパク質が十分に多くある場合は、多少のばらつきがあっても時計の仕組みが安定し、多くの細胞が正しく時間を刻み続けられることがわかりました。
一方でタンパク質量が少ないと、偶然に必要な成分が不足してしまう細胞が多くなり、時計としての機能が失われてしまいます。
こうして、実際の実験結果とモデルによる解析が完全に一致し、「細胞内で正確な時計を維持するにはタンパク質を潤沢に準備することが不可欠だ」という結論が明らかになりました。
さらに、このモデルを使用してシアノバクテリアの時計のもう一つの要素である遺伝子のオンオフによるフィードバックループ(TTFL)の役割についても分析しました。
その結果、TTFLは単一細胞の時計精度そのものにはあまり影響を与えませんが、多数の細胞のリズムを集団として揃えるためには欠かせないこともわかりました。
細胞それぞれの時計(PTO)は、個別に見ると非常に正確ですが、集団として見ると周期が4時間ほどズレることがあります。
放置すれば数日後には各細胞がまったく異なる時間を示すようになり、細胞集団としてのまとまりが失われます。
しかし、遺伝子のオンオフを司るTTFLがあると、毎日決まったタイミングで時計の状態が「リセット」されるのです。
このリセットとは、例えば朝に全ての細胞に「時計を合わせなさい」と指示を出すようなものです。
つまり、細胞集団の時間を揃えるためには、定期的なリセットの仕組みが欠かせません。
TTFLは、その役割を担っています。
TTFLが毎日周期的に働くことで、タンパク質量のばらつきや細胞間で生じたわずかなズレを補正し、全ての細胞の時計を再び揃え直しているのです。
これがTTFLの本質的な役割であり、多くの細胞が一体となってリズムを刻むために必要な「指揮棒」のような働きをしていると言えるでしょう。
【まとめ】生物の体内時計、その正確さを保つ2つの鍵
今回の研究によって、シアノバクテリアが非常に多くの時計タンパク質を作ることで、細胞内のノイズ(ゆらぎ)を抑え、高い精度で24時間という周期を維持していることが明らかになりました。
これは小さな細胞という限られた空間の中で、どうやって生物が正確な時間を保つのかという長年の疑問へのひとつの答えです。
生き物の体内では、さまざまな化学反応が常に起きていますが、これらは非常に小さなスケールで起こるため、常に揺らぎ(ノイズ)が伴います。
特に、シアノバクテリアの時計はリン酸という化学物質をゆっくりと付けたり外したりする反応で周期を作り出しており、こうしたゆっくりした化学反応はノイズの影響を強く受けるはずです。
実際、もし時計タンパク質が細胞内にわずかしか存在しなければ、偶然の揺らぎによって反応が乱され、時計としての機能を失ってしまう可能性が高くなります。
しかし実際には、シアノバクテリアは非常に多くの時計タンパク質を作り出すことによって、このノイズをうまく平均化し、時計の安定性を維持しています。
言い換えれば、生物は「量を増やすことによって質(精度)を確保する」というシンプルかつ巧妙な戦略を採用しているのです。
もちろん、生物にとって余分にタンパク質を作り続けることは、余計なエネルギーや資源の消費につながりますが、シアノバクテリアはそれを支払う価値があると判断しているのです。
なぜなら、正確な24時間周期を刻むことが、昼夜のリズムに合わせて活動するこれらの生物の生存にとって非常に重要だからです。
さらに今回の研究で重要だった発見の一つに、「時計を動かすタンパク質が細胞の膜に結合することで、一部のタンパク質が時計としての働きを失ってしまう」という現象があります。
つまり、細胞内にある時計タンパク質の全てが、時計としての機能を果たしているわけではなく、膜にくっついてしまい動かないタンパク質も多く存在しているのです。
これを補うために、生物は初めから多めのタンパク質を作り、少々膜に結合して働かないタンパク質が出ても問題ないように設計されているというわけです。
これは、一見無駄に見える余分なタンパク質を作ることが、実は生物が進化の中で得た優れた戦略である可能性を示しています。
今回明らかになったもう一つ重要なポイントは、シアノバクテリアの時計が2つの仕組みで成り立っていることに関係しています。
一つは「タンパク質だけでリズムを刻む振動子(PTO)」で、これは細胞一つひとつで高精度な24時間周期を保つことができます。
もう一つは「遺伝子がオン・オフを繰り返すことで時計を調節するフィードバックループ(TTFL)」で、こちらは個々の細胞の周期の安定性にはあまり影響しませんが、細胞が集団として時計のリズムを揃える上では非常に重要な働きをしています。
どういうことかというと、一つ一つの細胞が独立して時計を刻むPTOだけでは、細胞ごとのわずかなズレが時間とともに蓄積してしまい、次第に全体の同期が失われてしまいます。
このズレを毎日修正し、集団全体の時計のタイミングをリセットする役割を果たしているのがTTFLなのです。
言い換えるなら、PTOが各細胞にとっての「時計」そのものであるのに対して、TTFLはそれらの時計を調整する「指揮者」のような存在と言えるでしょう。
この二つの仕組みが連携することで、細胞一つひとつは高い精度を持ちながらも、集団全体が調和した24時間のリズムを刻めるようになっています。
こうして見ると、たった3種類のタンパク質だけでできている比較的シンプルな時計の仕組みが、これほど高精度で24時間周期を生み出すということは、生物が長い進化の中で作り上げてきた非常に洗練された戦略であることがわかります。
生物は単純な仕組みを基本として使いながらも、ノイズを克服するためにタンパク質を余分に用意したり、集団としてのリズムを揃える仕組みを別途用意したりと、複雑で巧妙な工夫を加えているのです。
このような、生物が持つ巧みな仕組みを人工的な細胞で再現できた今回の研究成果は、生命が持つ基本的な設計原理を理解する上でも非常に重要な一歩となります。
将来的には、この人工細胞を使って、細胞の大きさが異なる他の生物がどのように時計の精度を維持しているのかを調べたり、人工的に安定した周期を持つ新たな細胞回路を作り出したりすることも可能になるかもしれません。
今回の研究で得られた知見が、より複雑な細胞システムの構築や、現実の細胞に近い人工的な生命体を作り出すための新たな研究分野にも、大きな影響を与えることが期待されています。
参考文献
Tiny Artificial Cells Can Keep Time, Study Finds
https://news.ucmerced.edu/news/2025/tiny-artificial-cells-can-keep-time-study-finds
元論文
Reconstitution of circadian clock in synthetic cells reveals principles of timekeeping
https://doi.org/10.1038/s41467-025-61844-5
ライター
川勝康弘: ナゾロジー副編集長。 大学で研究生活を送ること10年と少し。 小説家としての活動履歴あり。 専門は生物学ですが、量子力学・社会学・医学・薬学なども担当します。 日々の記事作成は可能な限り、一次資料たる論文を元にするよう心がけています。 夢は最新科学をまとめて小学生用に本にすること。
編集者
ナゾロジー 編集部