はじめに 「量子力学」を考える上での注意
量子力学が難解な学問という認識は、誰もが抱いているでしょう。
では、なぜ量子力学は難しいのでしょうか?
その理由は、量子力学が本来は頭の中にイメージできるような概念を持っていないためです。
私たちの見るという行為は、基本的に光の反射で成立しています。しかし光子と同じサイズの世界を考えたとき、見るという行為は意味を持ちません。そもそもそこに視覚的なイメージは存在しないのです。
とはいえ、量子力学に関するさまざまな図解やたとえ話は、誰でも一度は目にしたことがあると思います。
これが大きな混乱の元であり、実のところ、図解で示される量子力学の世界はすべて厳密には正しくありません。
物理学とは、ニュートンからはじまり、目に見える現象の数々を説明する学問として発展してきました。
ところが、あるときこの理論が崩れ去り、既存の理論では一切説明のつかない事実が次々と発見されたのです。
それはたとえば、光が波として見ても、粒子として見てもどちらでも成立してしまう、という問題です。
これは頭でイメージしようとしても(あるいは図に描こうとしても)、思い描くことが不可能です。
そのため、物理学者たちはこのイメージできない新しい理論を「量子力学」と呼び、これまでの物理学(古典力学)と切り離しました。
しかし、物理学者も私たちも(数学者を除き)、何が起きているのかイメージできない問題を考えることは非常に不得意で、あまり好きではありません。
そこで、物理学者たちは、馴染み深い古典力学の概念を使って、なんとか量子力学の現象を可視化しようと試みました。
これが私たちのよく知る、量子力学の図説になったのです。
つまり私たちが知っている量子力学に関する説明はすべて、本来はまったく異なる概念である、古典力学によって無理やり描き出したイメージなのです。
そのため、同じ量子力学の問題でも、解説してる本やサイト、人物によって、全然説明の仕方や解釈が異なってしまう場合があります。
物理学者たちは、こうした問題をきちんと自覚した上で、うまく利用していますが、私たちはこの事実を理解していないため、頭がこんがらがってしまうのです。
これからはじめる量子力学のお話しも、できる限り視覚的なイメージを交えて解説していきますが、それはあくまで古典力学に置き換えた場合のイメージであって、正しい姿ではないのだということに注意してください。
量子力学はすべて、本来はイメージすることが不可能な問題であることを念頭におきながら見ていけば、多少は量子力学の理不尽な説明にも納得できるかもしれません。
目次
- 量子の発見
- 光は波?粒子?浮上した2重性の問題
- 物理学を揺るがしたもう一つの問題 「原子の中身」
- コペンハーゲン学派の開祖 ニールス・ボーアの登場
量子の発見

量子力学の歴史はマックス・プランクの行った黒体放射の研究から始まります。
これは光のエネルギーと色の関係を調べる研究でした。
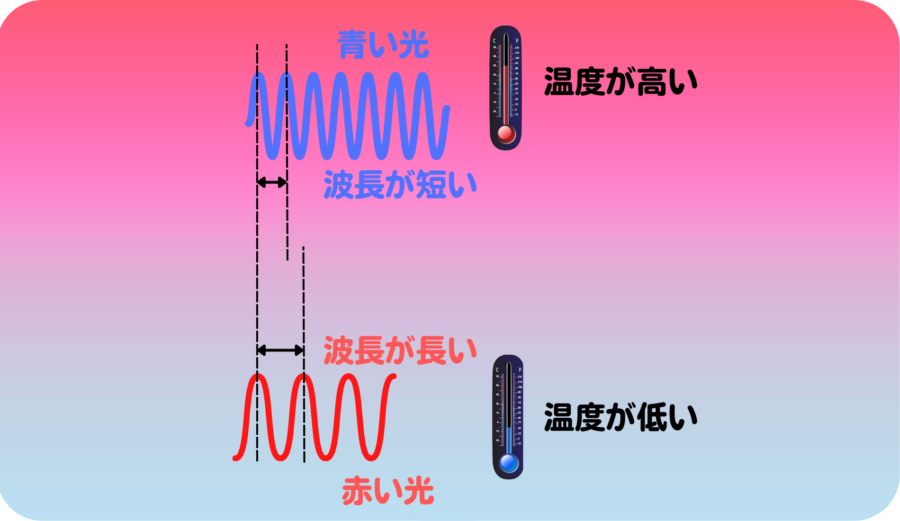
ガスバーナーやコンロの炎は赤色より青色の方が温度が高く、夜空の星々も赤より青く輝く方が高温の星です。
熱した物体は光を放ちますが、これは温度によって色が変わります。これは古くから知られている事実でした。
黒体放射の研究は、まさにこの物質の温度とそれが放つ光の色の関係を調べる研究であり、黒体という道具を熱してそれがどの温度だと何色に輝くかを調べます。
温度とはエネルギー量と言い換えることができるので、これまでの知識で考えた場合、高いエネルギーの光は青色に、低いエネルギーの低い光は赤色になると考えられます。
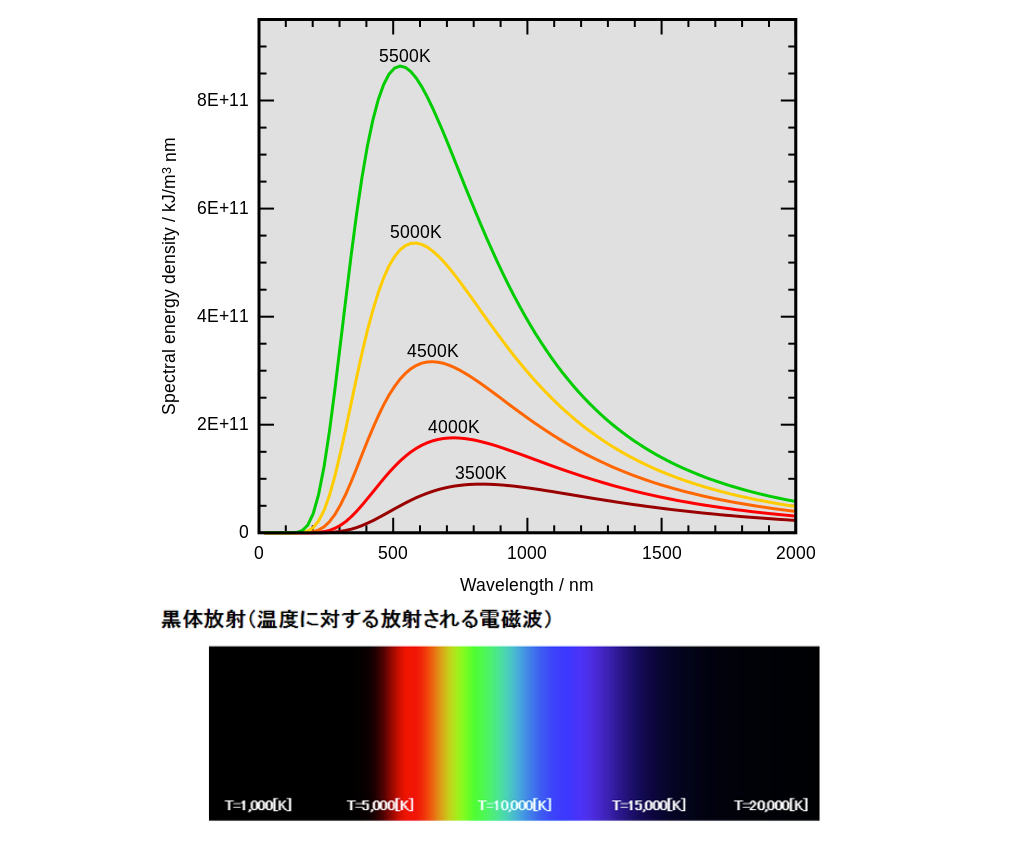
黒体放射の研究目的は、あるエネルギー量のとき光は何色に輝くかを予測する方程式を作ることでした。
この研究はプランク以前にも多くの研究者が挑戦していました。しかし、どういうわけか温度と色の関係を1つの方程式で表現することが誰にもできなかったのです。
普通に考えると、実験結果から、温度(エネルギー量)と光の色(波長)の関係を書き出していき、この数字にあった方程式を作ればいいだけなのだから、意外と簡単にこの研究は完成しそうな気がします。
ところが、どの研究者が作った方程式も、なぜか答えが長波長(赤い光)になるほど実験結果とズレてしまったのです。
なぜ波長が伸びるほど、計算と実験結果はズレてしまうのでしょうか?
波長(波と波の間の幅)が短くなると、振動数(ある区間内で波打つ数)は増えることになります。実験結果と方程式のズレは、研究者たちの予想よりも振動数が大きいときにエネルギー量が大きくなってしまうことを意味していました。
そこでプランクは、もっとも単純な解決策として、振動数に定数を掛けるというアイデアを採用します。
光が1回振動するときに現れる最小エネルギー量を実験結果から導き出し、定数として方程式に組み込んだのです。
それが「E = hν」という数式です。
Eとは光のエネルギー量、ν(ギリシャ文字「ニュー」)は光の振動数を表します。そしてhとして導入されたのが、プランクが実験から導き出した最小のエネルギー量「プランク定数」です。
プランク定数hは6.626 × 10-34という恐ろしく小さい値で、日常的なスケールではまず気づくことのできないものです。
そのため、こうした定数が存在することは、プランク以前に誰も気づいていませんでした。
こうして作り出されたプランクの方程式は、実際に検証してみるとピタリと実験結果と一致しました。
しかし、単に定数を掛ければうまく計算できる、なんてことは非常に単純な方法です。プランクの作った方程式を見て、手こずったと言う割には簡単な式だなと思った人もいるかもしれません。
なぜプランク以前の人々は、こんな簡単な方法に気づかなかったのでしょうか?
それは物理学者たちが当たり前の常識として、光を連続して変化する波であると考えていたからです。
プランクのやったように、振動数に定数を掛けてしまうと、光のエネルギーは「hν」という飛び飛びの値で変化することになってしまいます。
それはすなわち、光が連続した波ではなく、「hν」というエネルギーをもった粒子として捉えていることになってしまうのです。
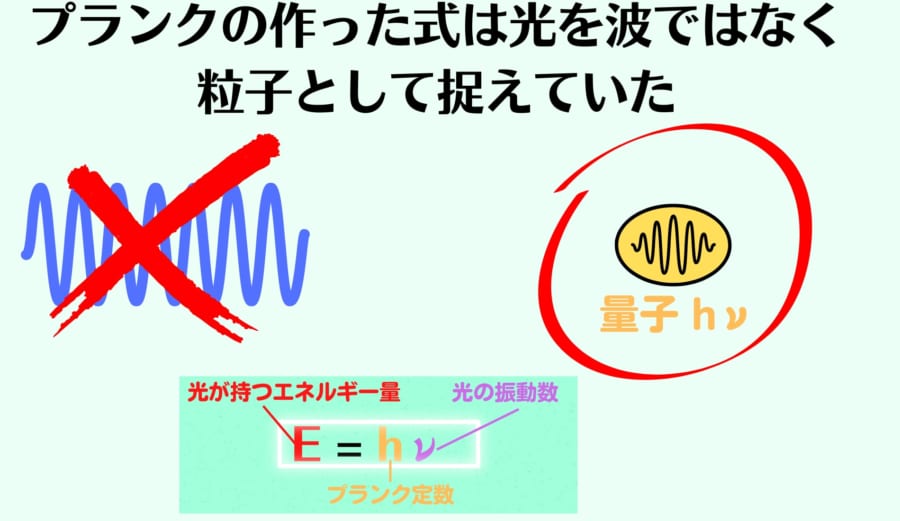
つまりプランクの方程式は、光を波として考えた場合、黒体放射を物理的なイメージで説明できていないということになってしまいます。
そのため、プランクはこれを単に計算の辻褄を合わせるためにやった窮余の策と考えていました。
プランク自身、光の正体が波ではなく、決まったエネルギー素量を持つ粒子だなんて信じることはできなかったのです。
けれど、この「hν」という塊は、後に量子と呼ばれることになり、物理学のさまざまな局面で重要な意味を持つようになるのです。
光は波?粒子?浮上した2重性の問題
光の2重性問題は古くからあり、かのアイザック・ニュートンは光を粒子だと考えていました。
しかし、同時代の物理学者ホイヘンスは、光がエーテルという媒質を伝わる波であると主張しました。
この議論は、最終的に光が波であることが実験によって証明されたため決着します。
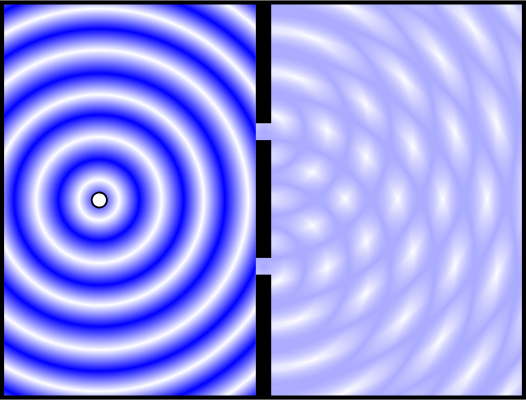
それが有名なヤングの二重スリット実験です。
この有名な実験は、光源の前に2つのスリット(隙間)を開けた衝立を置くと、その先のスクリーンに光が縞模様で映るという事実を示したものです。これは光が粒子であると考えると成立しません。
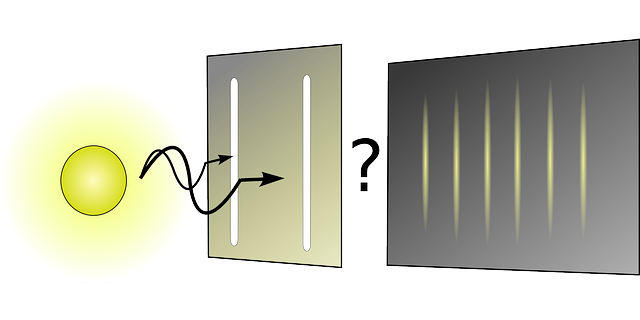
光が粒子であるならば、2重スリットの衝立の向こうにあるスクリーンには、2本の光の筋が映るだけになるはずです。
これを説明するためには、光が波であると考えるしかありません。
しかし、そんな物理学の常識は、アルベルト・アインシュタインの登場によって打ち砕かれます。
それがアインシュタインの発表した光電効果の法則です。
光電効果とは金属にぶつかった光に弾かれて電子が飛び出す現象のことです。
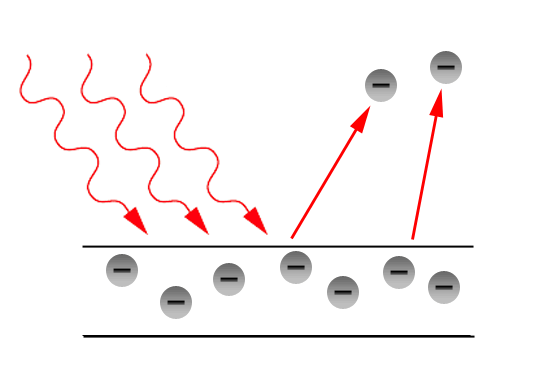
光電効果では、振動数の低い光は長時間照射しても、光量(明るさ)をどんなにあげても、電子が飛び出しません。
ところが照射する光量がどんなに弱くても、振動数の高い光を当てると電子が飛び出しました。
そして、飛び出す電子の運動量は振動数を増やすほど大きくなり、飛び出す電子の数は光量が大きくなるほど多くなったのです。
これは光を波として捉えた場合、うまく説明することができませんでした。
この問題に対して、アインシュタインは光が振動数に応じたエネルギーを持つ粒子だと仮定すれば、全てがうまく説明できることに気づきました。
例えば光をビリヤードの玉のような粒子として考えれば、振動数は玉を打ち出す強さということになります。だから弾かれて飛び出す電子の運動量は、振動数に応じて高くなります。
そして、明るくする(光量をあげる)ということは、光量子の数を増やしているだけだということになります。だから、光量を上げると飛び出す電子の数が増えるけれど、そもそも振動数が足りていなければ光量を上げても何も起こらないのです。
「電子を追い出すために必要なエネルギーは金属ごとに異なり、飛び出す電子の運動エネルギーは閾値となる光量子の振動数から始まる直線になるはずだ。そして、そのとき描かれるグラフの傾きはプランク定数hになるだろう」
それがアインシュタインの考えでした。
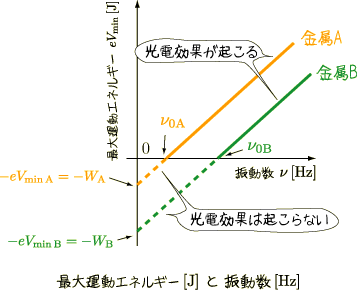
ここでアインシュタインは、光電効果を説明するために、プランクが生み出した量子仮説を利用します。
それは見事に現象を説明していました。
しかし発表当時、光を粒子と捉えるこの理論に多くの物理学者は懐疑的でした。
プランク自身さえ、アインシュタインの光量子に関する論文は素直に受け入れることはできなかったといいます。
アインシュタインは、現代においては偉大な物理学者ですが、当時はスイスの特許局に務める公務員で、仕事の傍ら論文投稿を行うアマチュア科学者でした。
彼の論文の完成度は高く評価されましたが、この時点では彼の主張を手放しで信用する人はいなかったのです。
しかし1921年、アインシュタインはこの光電効果の法則を発見した功績により、ノーベル物理学賞を受賞します。
アインシュタインは相対性理論でノーベル賞を受賞したと思われがちですが、ノーベル賞は基本的に同じ個人に対して一度だけ授与される賞のため、実は相対性理論で彼はノーベル賞をとっていないのです。
そう聞くと光電効果の法則の発見というのが、どれほど当時の学者たちにとって衝撃的なものだったのかイメージできるでしょう。
ただ、そのノーベル賞も、光電効果を説明する方程式の発見について評価したものの、光量子という概念の導入についてはスルーしました。
光を粒子と捉えるなんて、この時代の人たちにはどうしても受け入れがたい事実だったのです。
アメリカの実験物理学者ロバート・ミリカンもその1人で、アインシュタインの間違いを証明してやろうと、10年近くもかけて光電効果の詳細な実験を行いました。
しかしその実験で得られた結果は、全てアインシュタインが正しいことを示すものだったのです。
ミリカンは、この功績により思惑とは正反対にアインシュタインの光電効果理論を実験で証明した人として、ノーベル物理学賞を受賞してしまいます。
しかし、その受賞の場でさえも、ミリカンは「光が粒子であるとは考えられない」と語ったそうです。
結局光は波なのか粒子なのか? どちらについても有力な証拠が出てきてしまい、当時の物理学者たちは大いに混乱しました。
物理学を揺るがしたもう一つの問題 「原子の中身」
19世紀の終わりから20世紀の初め、光量子の問題と共に、もう1つ物理学界を揺さぶっていた問題があります。
それが原子の中はどうなっているのか? という問題です。
これは、レントゲンのX線発見の報告を発端に物理学の重要なテーマになっていきます。
この分野で目覚ましい活躍をした物理学者の一人が、アーネスト・ラザフォードです。

ラザフォードは、アルファ線、ベータ線(当時はウラン線と呼んでいた)の発見をはじめ、助手のガイガーと共に放射性崩壊による元素変換を発見してノーベル化学賞を受賞するなど、目覚ましい成果をあげます。
彼の功績はまだ原子の存在自体を疑問視する物理学者が多かった時代に、原子の実存性を決定付けるものでした。
そんなラザフォードとガイガーの最初の大きな功績は、アルファ粒子の正体がなんであるかを研究しているときに発見されました。
ガイガーは金箔にぶつけたアルファ粒子がたまにあり得ない方向へ散乱することに気づくのです。
さらに研究をすすめると、あろうことか跳ね返ってくる粒子があることも発見されます。

なぜ高いエネルギーを持つアルファ粒子が、薄っぺらい金箔で跳ね返るのか? これは紙の壁に大砲を打ち込んだら、そのまま弾がこちらへ跳ね返されたというくらい衝撃的な現象でした。
ラザフォードはこの原因が原子の構造にあると考えました。
そして、原子の中身が正電荷の大きな核を中心に電子が惑星のように軌道を描いて回っているという原子核モデルを思いつくのです。
アルファ粒子は正電荷の粒子です。アルファ粒子が極稀に跳ね返るのは正電荷の原子核にぶつかったためで、たまに散乱を起こすのは、原子核の周りに浮かぶ電子の極近距離を通って影響を受けたためと考えたのです。
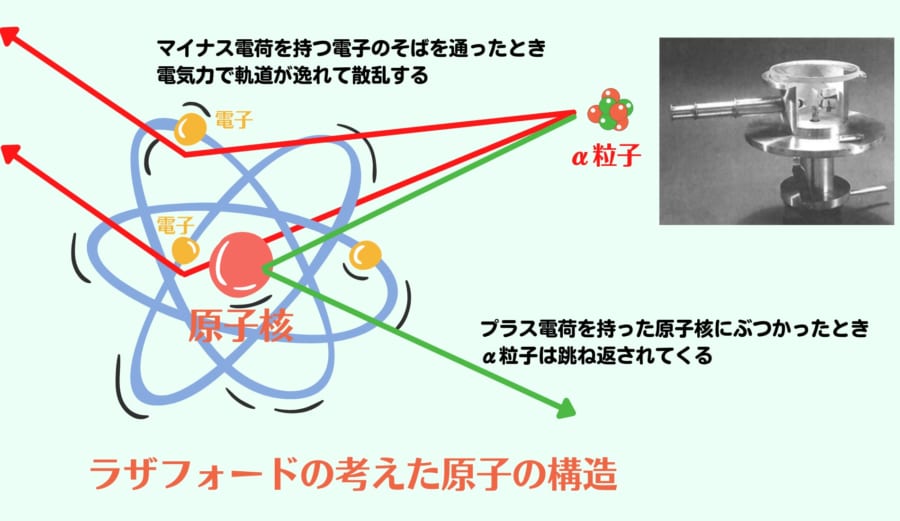
このときラザフォードの考えた原子核モデルは厳密には正しくないのですが、現代の私達が原子を思い浮かべるイメージの原型になりました。
そしてこのモデルは、正確では無いにも関わらず、カッコいいので今でもアメリカ原子力委員会の記章になっています。

正確でないということを強調しましたが、この辺りから物理学は新しく発見された事実を視覚的に表現することが難しくなってくるのです。そしてそれは現代まで続いています。
現代でも、多くの人は原子の構造と言われると上の米原子力委員会の記章を思い浮かべると思いますし、教科書にも上のような図が記載されていたりします。
しかし、このモデルは発表当時は真面目に受け取られませんでした。
なぜなら古典物理学の理論では、このモデルは成立しないからです。
電子のような荷電粒子が高速で運動した場合、そこからは電磁波が放射され、電子はたちまちエネルギーを失ってしまいます。これはマクスウェルの電磁気学から明らかにされている事実です。
そうなると電子は軌道を描いて惑星のように回り続けることはできず、たちまち原子核に墜落してしまうのです。
ラザフォードは実験結果からこれがかなり正しい原子の姿だと考えていましたが、本人を含めて当時は誰もそんな原子モデルが現実に成立するとは信じることができませんでした。
こうした中、ラザフォードの研究室に新たなメンバーとして加わったのが、量子力学の最重要人物ニールス・ボーアです。
コペンハーゲン学派の開祖 ニールス・ボーアの登場
量子力学の歴史を語る上で欠かすことのできない人物がニールス・ボーアです。
彼はこの歴史物語の最後まで、アインシュタインと共に登場し続けることになります。
当時のボーアはJ・J・トムソンの研究室に所属していましたが、知り合いにラザフォードを紹介され、その人柄に惚れ込んでラザフォードの研究室へと移籍してきます。

ボーアは、ラザフォードの考えた原子核モデルはかなり現実に近いと考えていました。
そして、原子核に電子が落ちないようにするためにはどうしたら良いかを考えはじめます。
そこでボーアが採用したのが、電子の軌道の量子化(飛び飛びの決まった値にだけ軌道が存在しているという考え方)でした。
電子は自由にどんな軌道でも回れるわけではなく、決まったエネルギー準位の軌道だけを回っていて、その軌道にあるときはエネルギー放射を行わないと仮定したのです。
これは実際はどうであれ、まずは実験結果と一致した法則を作り出すという、プランクと同様の手法でした。
こうした理論を模索する中で、ボーアはいくつかの重要な研究に出会います。
その1つが、当時物理学者たちの間で謎となっていた元素の線スペクトルの問題でした。
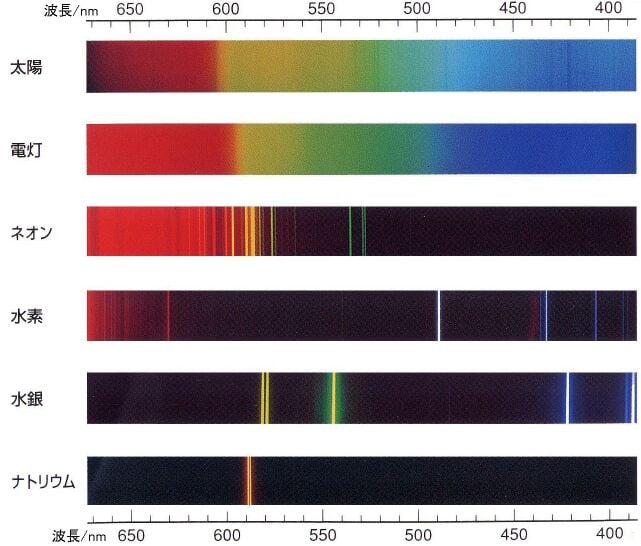
化学の分野に、金属を燃やしたとき元素に応じて炎の色が変わる炎色反応という現象があります。
これは昔から知られているものでしたが、19世紀になると、この炎が放つ光のスペクトルに特定の線が入るということが知られるようになります。
元素によってこの線のパターンは決まっていました。いわば線スペクトルとは元素ごとに持つ光の指紋なのです。
そのため線スペクトルは、現代では天文学において、はるか遠くの天体の構成元素を知るために利用されています。
しかし当時は謎の現象でした。
そんな中、数学者のヨハン・バルマーは実験データからこの線スペクトルの出現する波長を予測する方程式を見つけ出します。
ただ、線スペクトルが現れる理由はわかっておらず、なぜバルマーの式が線スペクトルを予測できるのか誰にもわかりませんでした。
しかし、バルマーの式を見たボーアは、これが電子の軌道に関係しているということに気づくのです。
そして、線スペクトルの正体は「原子内で電子が軌道をジャンプした際に放射したエネルギー」なのだと考えました。
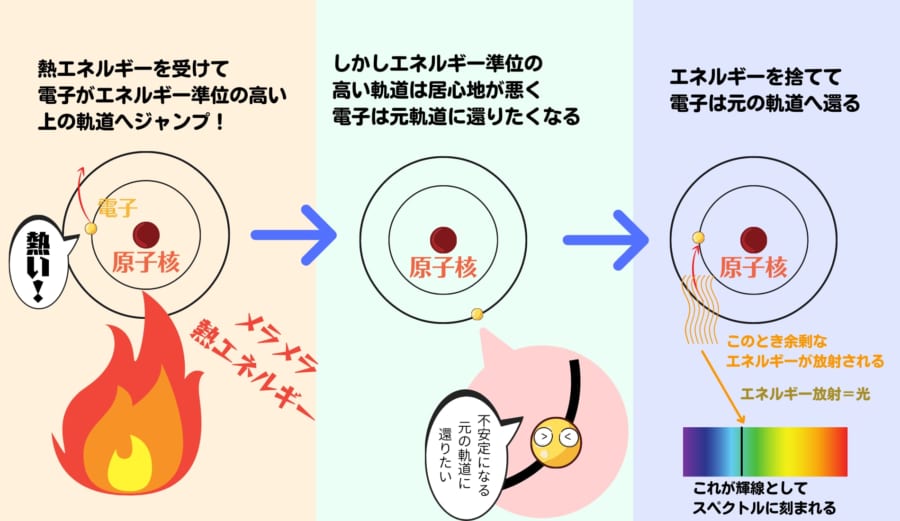
原子内で決まったエネルギー量の軌道を回る電子は、炎などで外部から熱エネルギーを受けた場合、エネルギー量の高い軌道へ移動します。
しかし、電子はすぐにそのエネルギーを放出して安定した最低エネルギー状態の軌道へ戻ろうとします。
そのため炎色反応の光には、この放出されたエネルギーが、光の筋となって線スペクトルに現れるのです。
ボーアの計算したところ、これは軌道ごとのエネルギー差の予想と見事に一致しました。
そして、このとき放出されるエネルギーも、やはりプランクが発見したhνという量子で導くことができたのです。
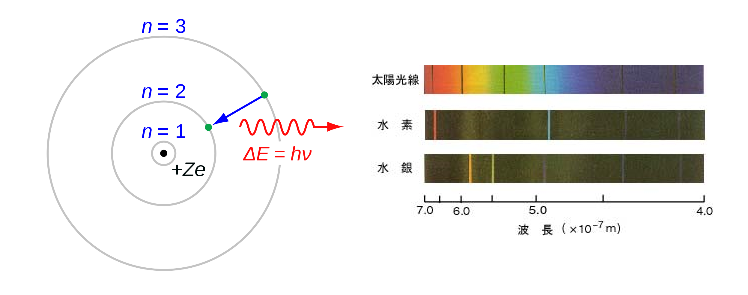
ラザフォードの原子モデルには「電子が原子核へなぜ落ちないのか?」という疑問がありました。
しかしそれは、ボーアによって、電子には安定軌道があると証明され解決します。
この原子モデルの確立というボーアの仕事は世界で高く評価され、彼はその功績により祖国デンマークのコペンハーゲンに自らの研究所を設立します。
それは後に、量子力学研究の重要拠点となり、世の研究者たちから「コペンハーゲン学派」と呼ばれることになるのです。

研究所設立の翌年、1922年、ボーアは原子物理学におけるこれらの功績によってノーベル物理学賞を受賞します。
量子力学の世界は、こうして少しずつ開拓されていきました。
しかし、この時点では、まだプランク定数で表現される量子が一体なんなのか? 単なる計算の都合なのか、誰も説明することは出来ませんでした。
ボーア自身もなぜ原子内の電子にはエネルギー放射を行わない安定軌道があるのか? その理由を説明することは出来ませんでした。
なにより、まだこの時点では量子力学という言葉も生み出されてはいません。
実験結果と一致する理論(方程式)が少しずつ、発見されていくだけだったのです。
参考文献
量子革命: アインシュタインとボーア、偉大なる頭脳の激突 (新潮文庫)
http://www.amazon.co.jp/exec/obidos/ASIN/4102200819/nazology-22/ref=nosim/
詩人のための量子力学―レーダーマンが語る不確定性原理から弦理論まで
https://www.amazon.co.jp/dp/4826901739
ライター
海沼 賢: 大学では電気電子工学、大学院では知識科学を専攻。科学進歩と共に分断されがちな分野間交流の場、一般の人々が科学知識とふれあう場の創出を目指しています。
編集者
ナゾロジー 編集部

