フィンランドのタンペレ大学(Tampere Univ.)を中心とする研究チームによって行われた最新の研究で、心筋梗塞(心臓発作)の原因の一つに、口の中に普段から棲みつく細菌(常在菌)が関与している可能性が示されました。
これらの細菌が血管の内部にバイオフィルム(細菌がねばねばした集合体を作って身を守る構造)を形成して免疫や薬から隠れており、ウイルス感染などのきっかけで一気に増殖すると、強い炎症が起きてプラークの破壊が進み、血管が詰まりやすくなるというのです。
つまり「感染→免疫の活性化→細菌の潜むプラークの破綻→血栓の形成→心筋梗塞」という一本の線が見えてきたのです。
プレスリリースのタイトルも「心筋梗塞は感染症の可能性があるかもしれない(Myocardial infarction may be an infectious disease)」とかなりセンセーショナルなものになっています。
これが本当だとすれば、将来的には心臓発作を感染症のようにワクチン(予防接種)で防ぐことも可能になるかもしれません。
研究内容の詳細は2025年8月6日に『Journal of the American Heart Association(JAHA)』にて発表されました。
目次
- 細菌と心臓発作の意外なつながり
- 心筋梗塞の原因となるプラーク中に「口の細菌」が含まれていた
- ウイルス感染などのキッカケから心臓発作が起こる仕組み
- くわしい解説(専門家向け)
細菌と心臓発作の意外なつながり
私たちの心臓は、全身に血液を送り出すポンプのような大切な役割を持っています。
心筋梗塞(しんきんこうそく)とは、その心臓の筋肉(心筋)に血液が行き届かなくなり、一部の心筋が壊死(細胞が死んでしまうこと)してしまう重大な発作です。
特に、日本だけでなく世界でも、心筋梗塞は生命を奪う病気の代表的なものの一つになっています。
実際、世界保健機関(WHO)によれば、心筋梗塞を含む心臓や血管の病気は世界で最も死亡者数が多く、その中でも特に心筋梗塞や脳卒中が大きな割合を占めています。
では、なぜ心筋梗塞が起きるのでしょうか?
その原因の多くは、日頃の生活習慣に関係していると考えられています。
例えば、脂っこい食べ物やファストフードを食べ過ぎるなどしてコレステロール(血液中の脂質の一種)が増えると、動脈(心臓に血液を送る管)の内側に「プラーク」という脂肪の塊が溜まります。
これが徐々に大きくなっていくと、何かのきっかけでプラークが破裂し、そこに「血栓(血液の塊)」ができて血管を詰まらせてしまうのです。
血液が止まると心臓に酸素が届かなくなり、心筋がダメージを受けてしまいます。
このようにして心筋梗塞が発症するのです。
しかし、近年の研究では「本当に生活習慣だけが原因なのだろうか?」という疑問も投げかけられています。
というのも、過去の研究から「感染症(ウイルスや細菌が引き起こす病気)」が心筋梗塞の発生に関係している可能性が指摘されていたからです。
実際に、インフルエンザや肺炎などにかかった直後には、心筋梗塞を含む心臓や血管のトラブルが一時的に増えることが知られています。
また、歯周病(歯の周りに炎症を起こす病気)など口の中の慢性的な感染症も、心臓病と関連があるのではないかと以前から疑われてきました。
コラム:ウイルス感染と体内の細菌の活性化
「風邪やインフルエンザ(ウイルス感染)がきっかけで、細菌(バクテリア)が一気に元気になる」――そんな現象は医学では昔から知られています。代表例はインフルエンザ後の二次性細菌性肺炎です。ウイルスが気道の粘膜(のど〜気管支の内側)を傷つけ、粘液を外へ運ぶ“ベルトコンベア”(繊毛運動)を止め、免疫(体を守る仕組み)の働きを一時的に鈍らせることで、ふだんは大人しい肺炎球菌や黄色ブドウ球菌などが増え、重い肺炎を起こしやすくなります。乳幼児で多いRSウイルスやライノウイルスの流行後に、中耳の奥に細菌(肺炎球菌やインフルエンザ菌)が増えて中耳炎が起こりやすくなるのも、同じ種類の「ウイルス→細菌ブースト」の一種です。
こうした指摘を受け、過去には抗生物質(細菌を倒す薬)を使って感染症を治療すれば、心筋梗塞を防げるかもしれないという考えで、大規模な臨床試験(実際に患者さんを対象にした実験的研究)が行われました。
ところが、この研究では、細菌感染を抗生物質で治療しても、期待したほどには心臓発作のリスクが下がりませんでした。
その結果を受けて「細菌と心筋梗塞の関係性」への注目は一時的に薄れていったのです。
ですが単に抗生物質が細菌に効かなかった可能性は捨てきれません。
というのも細菌たちはバイオフィルムという防御壁を作って、抗生物質や免疫から身を守りながら潜伏増殖できるからです。
そこで今回の研究チームは「プラーク内にどんな細菌がいるのか?」そして「心筋梗塞の発生にどう関係しているのか?」を詳しく調べることにしたのです。
心筋梗塞の原因となるプラーク中に「口の細菌」が含まれていた
心臓発作と細菌はどう関係するのか?
この謎を明らかにするために、研究チームは多くの人の血管の中身を詳しく調べました。
具体的には、病院の外で突然亡くなった121人の冠動脈(心臓に栄養を送る大切な血管)と、動脈硬化症(血管が硬くなり詰まりやすくなる病気)で手術を受けた96人の血管を集めて、合計で217人もの大規模な調査を行いました。
この血管の中には、動脈の壁に「プラーク」と呼ばれる脂肪のかたまりがあり、これが心筋梗塞を起こす主な原因と考えられています。
プラークは血管の内側に少しずつ蓄積していき、大きくなると血流を妨げます。
さらに、何らかの理由で破れると、その場所に血の塊(血栓)ができてしまい、血管を詰まらせてしまうのです。
今回の研究では、このプラークに細菌が潜んでいないかを調べるために、「DNA分析」という方法を使いました。
これは、細菌が残した遺伝子の痕跡を見つけることで、どんな細菌が血管の中にいたかを調べる方法です。
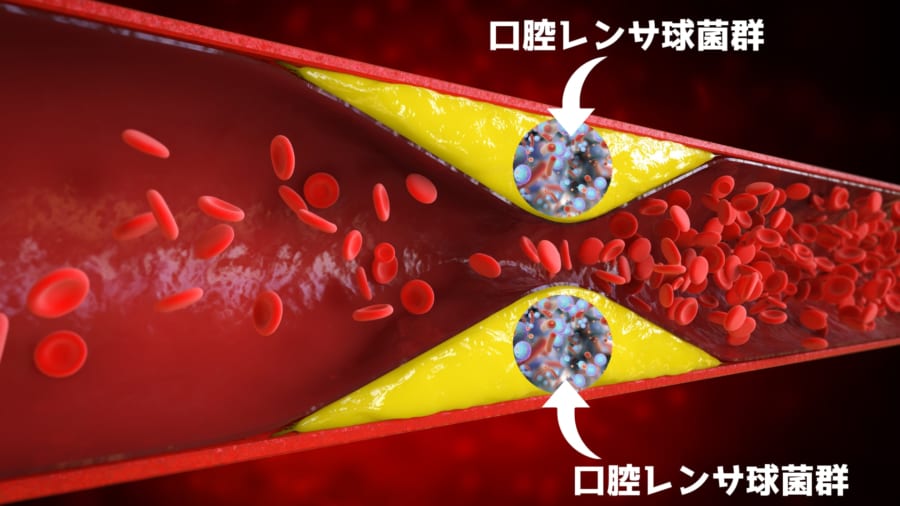
すると驚くことに、心臓の血管(冠動脈)のプラークのうち約42.1%、手術で取り出したプラークのうち約42.9%という非常に多くの割合で、「口腔レンサ球菌群(こうくうれんさきゅうきんぐん)」と呼ばれる細菌のDNAが見つかりました。
口腔レンサ球菌群は私たちの口の中に常に住んでいるごくありふれた細菌ですが、虫歯や歯周病を引き起こす原因の一部でもあります。
さらに研究者たちは「免疫染色」という方法を使って、この細菌がどこに潜んでいるのかを調べました。
免疫染色とは、細菌など特定の物質に色をつけて顕微鏡で見る方法です。
その結果、この細菌たちはプラークの中心部分で「バイオフィルム」という特殊なゼリー状の膜を作り、静かに隠れていることがわかったのです。
一方で、興味深いことに、プラークが破裂して心筋梗塞を起こした部分を詳しく観察すると、そこにはバイオフィルムから漏れ出したと考えられる細菌が存在しました。
またこの漏れ出した細菌を、私たちの免疫システムが「パターン認識受容体」というセンサーを使って見つけ出し、それに対して「獲得免疫」(過去の感染を記憶してより強力に反応する防御システム)が働き始め炎症も起き始めていることがわかりました。
これは、体が細菌の侵入に対して全力で抵抗しようとしている証拠でもあります。
ここから考えられる仮説としては、プラーク内で引きこもっていた細菌が出てきたことで、免疫との戦いが始まったというものです。
その結果として起きた炎症が、プラーク表面の繊維性被膜(フィブラスキャップ=“ふた”)を弱め、破綻(やぶれ)と血栓(血のかたまり)形成につながり得ることが示唆されます。
そして免疫に伴う炎症反応ががプラーク表面の繊維性被膜(フィブラスキャップ)を壊し、結果的にプラークの破裂と血栓形成を招いたと考えられます。
実際、本研究ではこの細菌の免疫染色の強さ(免疫陽性スコア)が動脈硬化の重症度と強く関連し、冠動脈疾患/心筋梗塞による死亡との統計的関連も報告されました。
言い換えると、ウイルス感染などの刺激をきっかけに、これまで静かだったプラークが免疫に認識されやすい状態になり、炎症経路の活性化を通じて被膜の脆弱化→破綻→血栓という流れに進みやすくなる可能性が見えてきた、ということです。
まだ原因を断定する段階ではありませんが、破裂部位での細菌の浸潤とTLR2経路の活性化(免疫の“見張り”のスイッチ)が同じ場所で観察されたことから、この機序は有力な仮説になり得ます。
ウイルス感染などのキッカケから心臓発作が起こる仕組み
この研究が示したのは、「心筋梗塞には細菌が関わっているかもしれない」という新しい視点です。
これまで心筋梗塞は、「生活習慣病」だと考えられてきました。
しかし今回の研究によって、実はその背後に「細菌」という隠れた要素が潜んでいる可能性が浮かび上がったのです。
もちろん「心筋梗塞菌」のような病原体があって、それが「人から人へと直接うつる」ということではありません。
この研究で明らかになったのは、私たちが日頃気づかないところで静かに潜んでいる細菌が、心筋梗塞の発作を起こす「引き金(トリガー)」になっている可能性です。
研究チームが注目したのは、「バイオフィルム」という細菌の集まりでした。
バイオフィルムはゼリー状の膜を作り、細菌が身を隠す秘密基地のような存在です。
普段、この膜の中にいる細菌は静かでおとなしいため、私たちの体の免疫(外敵を防ぐ体の仕組み)から見つかりにくくなっています。
ところが、ウイルス感染など何らかのきっかけでバイオフィルムから細菌が飛び出すと、免疫はそれを見つけて攻撃を始めます。
すると、攻撃された場所が炎症(赤く腫れたり熱を持ったりする防御反応)を起こし、それが動脈硬化のプラーク(血管の壁にできる脂肪のかたまり)を破り血栓となる可能性があるのです。
これは例えるなら、細菌という小さな火種が長い間静かに燃えていて、何かの拍子に炎症という「火事」が広がり、プラークという「壁」を壊してしまうというイメージです。
この発見が私たちに与える影響は非常に大きいでしょう。
これまで心筋梗塞の予防といえば、「運動をしましょう」「脂肪分の摂り過ぎに気をつけましょう」「コレステロール値を下げましょう」といった、生活習慣を改善することが中心でした。
もちろん、それは今後もとても大切です。
しかしこの研究結果は、「プラーク内の細菌への対策」も同じくらい重要な予防方法として検討される可能性を示しています。
具体的には、将来、口の中に住んでいる細菌(ビリダンス群連鎖球菌など)に対するワクチンの開発や、プラークの中でバイオフィルムが作られないように防ぐ方法が研究されるかもしれません。
また、血管の中に細菌が潜んでいるかどうかを事前に検査して、心筋梗塞のリスクを予測できるようになる可能性も考えられます。
またプラーク内の細菌を活性化させるようなウイルスに対してワクチンを接種すyることができれば、結果的に心筋梗塞の予防になるかもしれません。
もっとも、今回の研究はあくまでも、「細菌が心筋梗塞に影響を与えている可能性を示す証拠」を提供した段階であり、「原因」と完全に断定するには、さらなる研究が必要です。
ですが今後、この「プラーク内部に潜む細菌➔ウイルス感染などのキッカケ➔免疫の活性化とプラーク破壊➔血栓生成」という線を意識した研究が続けば、心筋梗塞を予防するための新たな方策へとつながるでしょう。
くわしい解説(専門家向け)
本論文は、冠動脈および末梢動脈のアテローム性プラークに口腔由来のバイオフィルム性細菌、とくにviridans streptococci(ミティス群など)が恒常的に潜み、免疫回避を行いながら、ある段階で“散逸(dispersal)”して線維性被帽へ侵入し、自然免疫・獲得免疫の活性化と線維性被帽の脆弱化を伴う破綻へ寄与しうる、という病態仮説を人試料の病理・分子・機能データを束ねて提示しています。
剖検連続例(突然死)と外科症例(頸動脈・大腿動脈・腹部大動脈)という二つの系列を用い、RT qPCR、免疫組織化学、TLR(toll like receptor)刺激系、そしてプラーク全遺伝子発現解析(GWE)を統合した設計が本研究の肝になります。
まず、検出のレイヤーでは、普遍的16Sプライマーによる“細菌DNAの存在”の確認に続いて、標的RT qPCRで主要口腔菌(ミティス群レンサ球菌、P. gingivalis、A. actinomycetemcomitans など)をプロファイルし、冠動脈プラークの65.7%、外科由来プラークの57.9%で細菌DNAが検出されました。
なかでもviridans streptococciのDNAは冠動脈で42.1%、外科プラークで42.9%と最も高頻度でした。
PCR系はATCC参照菌で特異性検証され、Ct閾値(多くは40、Streptococcus spp. とF. nucleatumは35〜37)やユニバーサル細菌測定のカットオフ(31〜33)を明示し、ΔΔCtで定量の相対評価を行っています。
試料採取は法医剖検室での陰圧・UV滅菌環境、NaOH/EtOH処理器具、同日搬送・凍結保存など、外来コンタミの系統的低減が記述され、動脈洗浄液の陰性対照も併置されています。
外科系列では健常対照としてLITA(内胸動脈)を用い、大半が病理学的に正常で免疫染色も陰性という“健常側の静けさ”が担保になっています。
組織学のレイヤーでは、ミティス群3種(mitis / sanguinis / gordonii)に対する自家作製抗体の混合パネルで免疫染色し、クロスリアクティビティを確認したうえで運用しています。
冠動脈359標本のうち60.4%、外科系列59標本のうち52.5%が免疫陽性で、アテロームの重症度が増すほど陽性率も上昇しました。
とくに線維脂性プラーク(AHA V)では約9割で“バイオフィルム様”集塊が脂質核や壁に沿って染まり、マクロファージマーカーCD68とはほぼ共在せず、免疫回避を示唆します。
一方、破綻・血栓を伴う複雑プラーク(AHA VI)では、すべてで強染色の散在性球菌が線維性被帽の破綻部へ浸潤し、CD68陽性マクロファージ内外に認められました。
これらはバイオフィルムからの“散逸”後に莢膜性の毒性表現型をとった菌である、という解釈が抗体特性(プランクトン型への高い反応性)と整合します。
面積定量では、免疫陽性スコア0/+/++/+++が、平均0%、1.8%、2.7%、8.7%の免疫陽性面積に相当することも示されています。
免疫活性化のレイヤーでは、破綻部において、TLR2、CD14、TLR4、NF κBが同一局所で共発現し、自然免疫の下流シグナル(MyD88依存)活性化を支持します。
さらにCD3 / CD247(CD3ζ)陽性リンパ球の集積が獲得免疫の関与も示します。
in vitroのHEK293安定発現TLR系では、グラム陽性のミティス群は濃度を問わずTLR2系(TLR1/2、TLR2/6)を主に活性化し、グラム陰性は低濃度でTLR4優位、高濃度でTLR2シフトという応答を示しました。
これら機能データは、組織で観察されたTLR2優位の発現像と呼応します。
遺伝子発現のレイヤーでは、外科標本のGWEでTLRシグナル経路(KEGG 04640)が最も強く上方制御され、エンリッチメントスコア0.721、nominal P=0.002、FDR=0.046が与えられています。
TLR2は約2.10倍、TLR4は約2.94倍の発現上昇を示し、97遺伝子中57遺伝子でトランスクリプトが有意に上昇していました。
つまり、“細菌認識の準備ができたプラーク”という分子背景のうえで、散逸した菌の局所侵入が自然免疫スイッチを押すというシナリオが、転写プログラム面からも裏づけられます。
臨床・病理相関として、剖検系列ではviridans免疫陽性スコアが冠動脈疾患死(P=0.0001)、全心筋梗塞死(P=0.002)、再発MI死(P=0.004)と強く関連し、初回急性MIでも傾向(P=0.056)が示されています。
RT qPCRのstreptococcal DNA量とも免疫陽性スコアが相関しました。
もちろん、因果の最終証明には介入的エビデンスが必要ですが、“無害な傍観者では説明しにくい”整合的な多層データが提示された点は重要です。
方法論的厳密性と限界も丁寧に議論されています。
剖検系列は地域の突然死を代表しますが、男性過多や外因死の偏りなどのバイアスを免れません。
外科系列では、試料が小さく石灰化によりDNA抽出が難しいため、RT qPCRは一部のみで偽陰性の可能性が残ります。
LITAを健常対照に用いた点への批判可能性も率直に記されています。
対照的に、採取・固定・洗浄を含む厳格な無菌手技、前免疫血清・アイソタイプ・DABのみ・異種菌抗体など多段の陰性コントロール、剖検系列と外科系列で類似する細菌プロファイルといった反証的検討が、コンタミネーション仮説の妥当性を低くする材料になっています。
「散逸した菌」がバイオフィルム由来か新規流入かの識別は難題ですが、バイオフィルム生態の既知のライフサイクルからは内因性散逸がより蓋然的と結論づけています。
機序仮説としては、アテロームが拡大し低酸素に適応して新生血管が入り込むと、一過性菌血症(歯科処置や急性気道感染などに伴う)を経由して口腔由来菌が脂質核・壁に付着しバイオフィルム化、免疫回避状態で潜伏します。
その後、未知のトリガー(呼吸器ウイルス、カテコールアミン、鉄、脂肪酸シグナルなどが候補)で莢膜性の毒性表現型へリプログラムされた次世代菌が散逸し、TLR2優位の自然免疫経路→NF κB→IL 6やTNF→MMP群の誘導→コラーゲン分解→被帽破綻と血栓形成という炎症‐構造脆弱化カスケードを増幅すると描かれます。
これは、感染後短期にMIリスクが跳ね上がる疫学所見や、endocarditisで見られるバイオフィルム性の慢性感染の病態とも親和的です。
臨床的含意として、過去の長期マクロライド投与などの抗菌薬介入が陰性に終わった一因を、“バイオフィルムの薬剤到達不全と免疫回避”に求める論旨は説得的です。
著者らは次の問いとして、急性期短期抗菌薬の転帰影響、バイオフィルムの画像診断や予防法の開発可能性を挙げています。
これは“感染症として治す”という単純化ではなく、「プラーク進展の複雑化(complication)」における細菌学的成分の介在という、病態生物学のアップデートです。
最終結論は控えめに“may contribute”の域にとどめられており、因果の確証は今後の介入研究と生体内イメージング、メカニズム実証に委ねられます。
病因の多因子性を踏まえるなら、本研究は脂質・免疫・微生物の三位一体モデルへ舵を切るための、現時点で最も重層的な人データの提示と評価できます。
参考文献
Myocardial infarction may be an infectious disease(心筋梗塞は感染症の可能性があるかもしれない)
https://www.tuni.fi/en/news/myocardial-infarction-may-be-infectious-disease
元論文
Viridans Streptococcal Biofilm Evades Immune Detection and Contributes to Inflammation and Rupture of Atherosclerotic Plaques
https://doi.org/10.1161/JAHA.125.041521
ライター
川勝康弘: ナゾロジー副編集長。 大学で研究生活を送ること10年と少し。 小説家としての活動履歴あり。 専門は生物学ですが、量子力学・社会学・医学・薬学なども担当します。 日々の記事作成は可能な限り、一次資料たる論文を元にするよう心がけています。 夢は最新科学をまとめて小学生用に本にすること。
編集者
ナゾロジー 編集部